

Olá!
Agora, neste e no próximo tópico, vamos ver como no final do século XIX e início do século XX ocorreu uma revolução na física da estrutura da matéria. A descoberta do elétron mostrou que o átomo é composto por outros elementos menores tendo, portanto, uma estrutura interna. A palavra átomo perdeu o seu significado original, mas continuou sendo utilizada até hoje. Novos modelos do átomo surgiram, procurando agregar as descobertas do quantum e do elétron, inicialmente utilizando a Física Clássica, mas logo foi necessário o uso de ideias revolucionárias, que explicavam muito bem os dados experimentais. Nasceu, assim, uma nova física, que tem o seu palco em fenômenos com dimensões atômicas.
Iniciamos este tópico com os modelos atômicos clássicos e chegamos até o modelo quantizado de Bohr. No próximo tópico, apresentaremos o modelo mais completo de Schrödinger, com três números quânticos.
Veremos a evolução desses modelos que saíram da Física Clássica e chegaram à Física Quântica. Analisaremos o átomo mais simples, composto de um próton e um único elétron, o átomo de hidrogênio.
 A
palavra átomo foi utilizada pela primeira vez por Demócrito, em 400
a.C., na
Grécia antiga, para designar a menor porção, indivisível, da matéria.
Esta ideia permaneceu por mais de 2.200 anos, até 1899, dois anos após
J.J. Thomson
ter descoberto os elétrons. Como os elétrons possuem carga negativa e o
átomo
carga neutra, Thomsom propôs o modelo atômico que ficou conhecido como
"pudim de
passas". Neste modelo, o átomo era uma esfera maciça, constituída por
material
com carga positiva, e os elétrons ficavam incrustados em anéis
concêntricos, em
quantidade tal que a carga total do átomo fosse neutra.
A
palavra átomo foi utilizada pela primeira vez por Demócrito, em 400
a.C., na
Grécia antiga, para designar a menor porção, indivisível, da matéria.
Esta ideia permaneceu por mais de 2.200 anos, até 1899, dois anos após
J.J. Thomson
ter descoberto os elétrons. Como os elétrons possuem carga negativa e o
átomo
carga neutra, Thomsom propôs o modelo atômico que ficou conhecido como
"pudim de
passas". Neste modelo, o átomo era uma esfera maciça, constituída por
material
com carga positiva, e os elétrons ficavam incrustados em anéis
concêntricos, em
quantidade tal que a carga total do átomo fosse neutra.
Entretanto seu modelo não durou muito, pois,
quando em 1908, Ernest Rutherford realizou experiências de bombardeio
de lâminas
de ouro com partículas alfa (partícula com grande massa e carga
positiva
liberada por elementos radioativos), os resultados experimentais o
levaram a
concluir a existência de um núcleo central no átomo, com carga
positiva, e
possuindo quase toda a massa do átomo.
Assim foi descoberta a existência do núcleo atômico!
Na simulação abaixo (clique na figura), você pode ver a previsão desses dois modelos de átomo para o espalhamento das partículas alfa, quando jogadas na direção do átomo. Divirta-se!
Os modelos clássicos do átomo não conseguem explicar sua existência e a estabilidade da matéria. O modelo eletrostático é excluído, pela impossibilidade de levar a uma configuração de equilíbrio estável das cargas elétricas. Já o modelo dinâmico planetário, com os elétrons orbitando o núcleo, também apresentava dificuldades insuperáveis, pois os elétrons nesta situação possuem aceleração diferente de zero (aceleração centrípeta), logo, perdem energia pela emissão de radiação, segundo a Teoria de Maxwell, e assim seguem uma órbita em espiral, que termina com a sua captura pelo núcleo. O átomo não duraria mais de 10-9 segundos!
Niels Bohr, físico dinamarquês, foi quem propôs o primeiro modelo
quântico do átomo. Em 1913, ele apresentou um modelo para o átomo de
hidrogênio que combinava as ideias de Planck, Einstein e Rutherford.
E agora, que tal um cineminha? Prepare as pipocas e assista ao vídeo abaixo sobre o átomo de Bohr, que mostra a passagem da Física Clássica para uma nova física: a Física Quântica. Bom divertimento!
No início do século XX, os físicos não conseguiam explicar a existência das linhas espectrais do átomo de hidrogênio. Eles não conseguiam responder às seguintes perguntas:
Por que o hidrogênio só emite em certas raias, na região do espectro visível?
Por que ele só absorve nestas mesmas raias?

Bohr acrescentou às ideias de Planck, Einstein e Rutherford três postulados e conseguiu explicar os espectros do átomo de hidrogênio.
1) Estados estacionários - O elétron se move em órbitas
circulares em torno do próton, sob a influência da força coulombiana.
Mas somente um conjunto discreto de órbitas é estável e, nestes
estados, o átono não irradia. 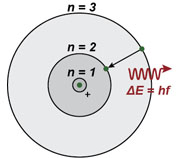
2) Emissão e absorção de radiação - Quando um elétron passa de um estado estacionário inicial Ei, com energia maior, para outro estado estacionário Ef, com energia menor, ele emite radiação. Se o estado inicial for o de menor energia, o átomo absorve um fóton com energia E=hf.
3) Quantização do momento angular - O tamanho das possíveis órbitas do elétron é determinado pela condição de quantização do momento angular, dada por:
onde: m e v são a massa e a velocidade do elétron, r é o raio da sua órbita, h corresponde à constante de Planck e n é o número quântico que define os valores discretos do momento angular.